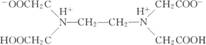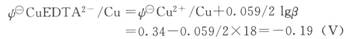乙二胺四乙酸(EDTA) (一)EDTA的性质 乙二胺中四个氢原子被四个乙酸取代,构成乙二胺四乙酸。 白色晶体的EDTA熔点为244.5℃,不溶于乙醇、丙酮和苯,在水中溶解度只有0.02g/100g H20 22℃。常用的试剂是其钠盐,简写成Na2H2Y·2H20,相对分子质量为372.25。它的溶解度与温度关系如下:
乙二胺四乙酸结构式如下。
2个羧基上的H转移至N原子上,形成双极离子。 EDTA分子中含2个可以键合的N原子,2个可键合的O原子,即6个配位原子。他们能在空间上与同一金属离子配位,大多数金属离子配位数都不超过6,所以一般均形成l:1络合物。它形成的螯合物立体结构有3个或5个五元环,相当稳定。 EDTA二钠盐在22℃时,每l00mL水可溶解ll.1g,此溶液的浓度约为0.3mol/L,pH值约为4.7。 (二)EDTA与铜离子的络合作用 EDTA在化学镀铜中通常用作铜离子的络合剂。可能是因为它对大多数金属离子都有较强的络合能力而引起镀液中金属杂质的积累和废水处理的难度,因而较少作为络合剂用于电镀铜工艺。 EDTA为四元酸,可表示为H4EDTA,常用的钠盐为二钠盐,表示为Na2H2EDTA。其二钠盐与Cu2+形成l:1络合物,在pH值较高时,主要以[CuEDTA]2一的形式存在。 Cu2++H2EDTA=[CuEDTA]+2H+ EDTA与Cu2+络合物的稳定常数随pH值变化的关系如下。
由数据可知,在pH值较高时EDTA对Cu2+络合能力很强,使铜电极的电位负移。不考虑pH值的影响,也不考虑其他形式的络离子,铜电极在CuEDTA2一中的电位:
|