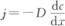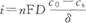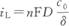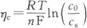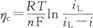过电位的种类 极化现象的发生是由于电极反应有阻力,为克服阻力使反应以一定速率进行就要消耗额外的电能。一个电极反应可包括许多单元步骤,其中最基本的是反应物在电极表面得失电子的电化学步骤和反应物从溶液本体向电极表面补充的液相传质步骤。这两个基本步骤都有相应的阻力,为通过一定的电流密度,都需要相应的过电位;总的过电位是这两个过电位共同引起的。 (一)电子交换步骤的过电位 电子交换步骤的过电位,也称为电化学极化。在开路条件下,虽然无电流通过电极(无净的电极反应),但电极和溶液的界面上实际上发生着相同速率的金属溶解和沉积反应这一对相反的电化学反应。这种动态平衡下的反应速率对于不同电极反应体系可相差许多个量级。这种反应的速率可折算成电流密度,称为交换电流密度,通常记为iΘ。开路条件下,若仅存在这个唯一的电极反应,则金属溶解及金属离子还原成金属的速率都等于iΘ,故电极无净电流通过。当电极电位负于平衡电位时,金属离子还原沉积的速率大于iΘ,而金属溶解的速率小于iΘ,二者相抵还有净的还原电流,即电极上有金属被沉积出来。电极电位正移时情况相反。对实际的电镀电极,在通过的(净)阴极电流密度比iΘ大得多时,该电极上金属溶解的速率可忽略不计。此时电极的阴极过电位叩与阴极电流密度i之间的关系服从Tafel公式. η=a+6lgi 式中,a和b由电极反应体系的性质(被镀金属种类,槽液组成等)决定,对所讨论电极反应体系有重要的表征作用。虽然大的电化学极化意味着大的电能损失,但电镀中却需要大的电化学极化。因为只有在大的电化学极化的条件下,才能得到致密的镀层。提高电化学极化的主要途径是使用添加剂。 (二)传质过程的过电位 电镀过程中电极表面附近溶液中的金属离子被不断消耗,必须从溶液本体得到补充。反应物从溶液本体到电极表面的物质传输过程简称传质过程。搅拌或自然对流是加强传质的有效方式。但在电极表面总存在一个薄层溶液(称为扩散层),其中对流的传质作用可不计。金属离子通过这一薄层的传质方式是扩散,其传质速率由扩散公式描述。
式中j--扩散速率; D--扩散系数; dc/dz--金属离子在扩散层厚度方向的浓度梯度。 引入扩散层有效厚度艿,并用电流密度表示扩散速率,上式可改写为:
式中,C0和Cs分别为金属离子在溶液本体和电极表面的浓度。对反应物(被沉积金属离子)而言,有Cs<C0。而且,由扩散决定的电流密度是有极限的。当表面金属离子浓度降到零时,电流密度就达到了扩散极限电流密度,iL。
溶液本体的对流快,则扩散层有效厚度小,扩散极限电流密度大。 从上述讨论可见,因扩散阻力的存在,电极有电流通过时,电镀电极表面附近的金属离子浓度比溶液本体的浓度小。根据能斯特公式,电极电位必然比开路时的负。由此引起的过电位与表面浓度的关系为:
因表面浓度与电流密度有关,故可将上式改写为
上式表明,在给定的传质条件下,传质过电位随电流而增大;对给定的电流密度,增大iL可减小传质过电位。传质过电位又称浓差极化。与电化学极化不同,电镀中应设法减小浓差极化。这主要不是为了降低电能损耗,而是为了避免浓差极化对镀层质量的不利影响。当浓差极化大时,即金属离子表面浓度小时,镀层会变得粗糙,出现雾状或"烧焦"(发黑)现象。提高槽液温度以增大D、加强对流以减小δ、增加本体浓度等手段,都能通过增大iL而减小浓差极化。 |