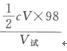方法一(碘量法) (1)方法摘要 在微酸性溶液中,铜离子和碘化钾定量地反应生成碘,以硫代硫酸钠滴定,可测出铜的含量。以淀粉为指示剂。 (2)试剂 ①冰醋酸。 ②碘化钾固体。 ③淀粉指示剂。见试剂(25)。 ④0.1mol/L硫代硫酸钠标准溶液。见试剂(6)。 (3)分析方法 用移液管精确取2mL镀液于300mL锥形瓶中,加水lOOmL、冰醋酸lomL、碘化钾3g、少量淀粉指示剂,用0.1mol/L硫代硫酸钠标准溶液滴定,由黑褐色变为乳白色为.终点。 (4)计算 ρCuS04(g/L)=12.5V×0.1mol/L硫代硫酸钠的因数 式中 V——硫代硫酸钠标准溶液的滴定值,mL。 0.1mol/L硫代硫酸钠lmL---0.006357gCu。
方法二(EDTA法) (1)方法摘要 加氟化铵和氨水掩蔽金属杂质,在微碱性溶液中,以PAN为指示剂,用EDTA滴定铜。 (2)试剂 ①氟化铵固体。 ②1:1氨水。 ③PAN指示剂。见试剂(24)。 ④0.05mol/L EDTA标准溶液。 (3)分析方法 用移液管准确取lmL镀液于300mL锥形瓶中,加水100mL、氟化铵lg、1:1氨水20mL、PAN指示剂数滴,用0.05mol/L EDTA标准溶液滴定,溶液由红紫色变为绿色为终点。 (4)计算 ρCuS04(g/L)=12.5V×0.05mol/L EDTA的因数 式中 V——0.05mol/L EDTA溶液的滴定值。 0.05mol/L EDTA lmL=0.01248gCuS04·5H20。
方法三(硫酸和铜的连续测定) (1)方法摘要 基于酸碱滴定,以甲基橙为指示剂,以氢氧化钠标准溶液滴定硫酸,然后加缓冲溶液提高pH至10,用PAN为指示剂,以EDTA滴定铜。 (2)试剂 ①甲基橙指示剂。见试剂(17)。 ②0.1mol/L氢氧化钠标准溶液。见试剂(3)。 ③缓冲溶液(pH一10)。见试剂(30)。 ④0.1%乙醇溶液的PAN指示剂。见试剂(24)。 ⑤0.05mol/L EDTA标准溶液。见试剂(1)。 (3)分析方法 吸取镀液lmL于250mL锥形瓶中,加水100mL、甲基橙1~2滴,以0.1mol/L氢氧化钠溶液滴定至溶液由红变黄色为终点(V)。加缓冲溶液lomL、PAN 3滴,以0.05mol/L EDTA标准溶液滴定至绿色为终点(V1)。 (4)计算 含硫酸ρH2SO4(g/L)= 含铜ρCu(g/L)= 式中 c——氢氧化钠标准溶液的浓度; C1——EDTA标准溶液的浓度; V——耗用氢氧化钠标准溶液的体积,mL; V1——耗用EDTA标准溶液的体积,mL; V试——所取镀液体积,mL; 98——MH2S04, 63.55——MCu |