|
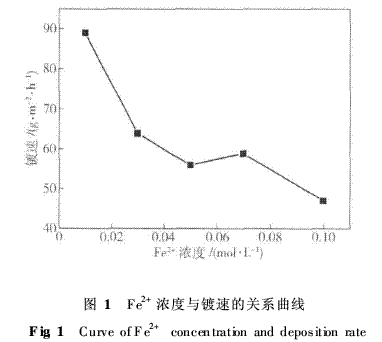
关 键 词:电沉积,镀层,镍合金,钢,耐蚀性,电化学性能 作 者:史艳华 内 容: 辽宁石油化工大学机械工程学院石油化工过程腐蚀与防护技术中心,抚顺113001 摘 要:采用电沉积技术在20号钢表面制备了Fe--Ni合金层,考察了镀液中Fe2+浓度对合金镀层沉积速度、镀层成分、相结构、镀层显微硬度和耐蚀性的影响规律,并探讨了耐蚀机理.实验结果表明:电镀Fe--Ni合金可获得纳米晶结构,随镀液中Fe2+浓度增加,镀层中含铁量增大;镀层显微硬度的变化与Fe原子在Ni晶格中有序固溶程度有关; Fe--Ni合金镀层的耐蚀性均优于20号钢,当镀液Fe2+浓度为0·01mol·L-1时,获得镀层具有最佳的耐蚀性.随镀层中铁含量增加,具有钝化特性的高含Ni的Fe--Ni相含量减少,耐蚀性下降,但该相纳米结构显著细化,加速钝化可提高耐蚀性,这一对矛盾导致镀层耐蚀性与铁含量间没有明显的变化规律.高孔隙率也是耐蚀性下降的原因之一. 关键词:电沉积;镀层;镍合金;钢;耐蚀性;电化学性能 分类号:TQ153·2 电镀Fe--Ni合金起源于20世纪70年代[1--2],期望用低廉的铁取代部分贵重镍获得优质的Ni--Fe合金镀层而取代全镍镀层材料,这一工艺的发展不仅可大大降低生产成本,而且把镀镍液中有害铁杂质变为合金镀液中的有用成分,排除了镀液管理中一大难题. Fe--Ni合金镀层具有优良的物理和化学性能[3--4],尤其是优良的耐蚀性能和耐磨性能,使其很短时间内就在防护--装饰电镀领域打下坚固的基础,曾被赞扬是“十年中最显著的发展”,被广泛应用于自行车、缝纫机和日用五金等产品的防护装饰性镀层及修复行业而快速发展起来[5--6]. 目前,常用的Fe--Ni合金电镀工艺有两种:一种是高Fe--Ni合金电镀,铁的质量分数为25% ~35%;另一种是低Fe--Ni合金电镀,铁的质量分数为8% ~12%[7],主要是以Ni为基,在镀镍液中添加Fe盐和其他添加剂而获得.从目前的研究结果来看,Fe--Ni合金镀层耐蚀性与镀层含铁量关系很大:Tomlinson等[8]的研究表明,在0·5mol·L-1H2SO4介质中,随着铁含量的增大,腐蚀速率增大,当铁的质量分数为20% ~40%时,Ni--Fe合金镀层的腐蚀速率最小;Ramazan Solmaz研究了铁的质量分数大于65%的Fe--Ni合金的耐蚀性,铁的质量分数89·5%的Fe--Ni合金耐蚀性最差[9];也有研究表明在纳米镍中加入适量的铁可以提高其耐蚀性[10--12]. Fe--Ni合金镀层耐蚀性与镀层含铁量的关系遵循怎样的规律,有待进一步研究. 镀液Fe2+浓度是影响镀层含铁量的主要因素.本文采用电沉积技术,以工业最常用的20号钢为基材,通过调整Fe2+浓度制备出不同含铁量的Fe--Ni合金镀层,通过对镀层的结构分析、显微硬度和耐蚀性的研究,以获得Fe--Ni合金镀层结构与性能间的构效关系. 1实验方法 本研究采用的镀液配方为1·14mol·L-1NiSO4·6H2O、0·19mol·L-1NiCl2、0·01~0·1mol·L-1FeSO4·7H2O、0·49mol·L-1H3BO3、1mol·L-1NH4Cl、1mol·L-1NaCl、0·01g·L-1十二烷基硫酸钠、0·4mol·L-1C6H5Na3O7·2H2O和0·5mol·L-1C6H8O7·H2O.镀液pH值为2,电镀温度为30℃,阴极电流密度为2A·dm-2,搅拌速度为250 r·min-1,电镀60min.试样尺寸为20mm×20mm×2mm,采用直流稳压电源和IrTaSn/Ti阳极.电镀工艺流程:打磨→水洗→碱洗→水洗→酸洗(8%盐酸2min)→水洗→电镀→水洗→吹干.对制备的试样采用KYKY--2800能谱仪测试成分,采用D/max 2000PC X射线衍射仪检测镀层合金的相结构. 电化学实验:采用传统的三电极体系在3·5%NaCl溶液中做极化曲线和电化学阻抗谱测试.实验选用美国2273电化学工作站,工作电极为Fe--Ni合金镀件,参比电极为饱和甘汞电极(SCE),辅助电极为铂片. 2结果与讨论 2·1镀液中Fe2+浓度对镀速与镀层成分的影响 图1为镀液中Fe2+浓度与镀速的关系曲线.由图可见:Fe--Ni合金镀层的镀速随镀液中Fe2+浓度增大而呈降低趋势,当Fe2+浓度在0·03~0·07mol·L-1时,镀速下降趋缓,约为60g·m-2·h-1.
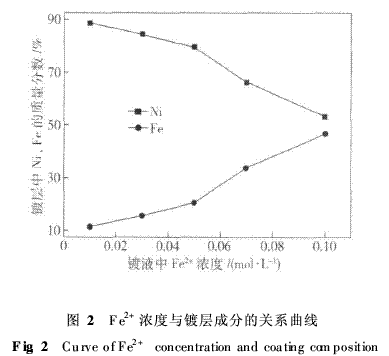
图2为镀液中Fe2+浓度与镀层中Fe、Ni含量的关系曲线.由图2可见:镀液中Fe2+浓度对镀层中含Fe量影响显著,镀层中Fe含量随镀液中Fe2+浓度增加而增加,当镀液中Fe2+浓度低于0·03mol·L-1时,可获得低Fe镀层;镀层中含Ni量随镀液中Fe2+浓度增加呈相反变化趋势.
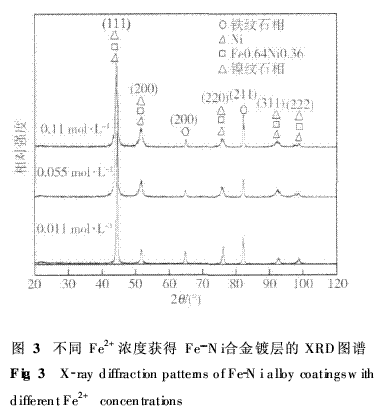
2·2镀液中Fe2+浓度对镀层合金相结构的影响 图3为不同Fe2+浓度镀液获得的镀层的XRD图谱.由图可见,镀层合金由Ni和Fe0·64Ni0·36、镍纹石(Fe0·79Ni0·21)、铁纹石相(Ni质量分数为5% ~ 7% )等Fe--Ni合金相组成,其中Ni、Fe0·64Ni0·36和镍纹石相在2θ为44°、51°、76°、92°和98°处具有相同的晶面指数且衍射峰重合.从XRD图谱中没有发现单质铁的衍射峰,且随镀层中含铁量增加,Ni、Fe0·64Ni0·36和镍纹石相在2θ为44°时衍射峰明显降低,铁纹石相在2θ为82°处的衍射峰显著增强.
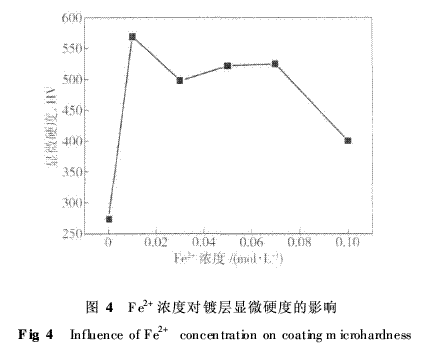
分析认为:Ni和几个合金相均具有面心立方结 构,而Fe与Ni的原子半径相差不超过1%,Ni、F的原子半径分别为0·125nm和0·124nm,Fe原子可以用置换的方式固溶到Ni的晶格中形成不同含铁量的Fe0·64Ni0·36、镍纹石相和铁纹石相,同时产生一定程度的晶格畸变.与标准PDF卡片相对照,图谱中Fe0·64Ni0·36和镍纹石各衍射峰所对应的2θ值左移,晶面间距变大,而铁纹石各衍射峰所对应的2θ值右移,晶面间距变小. 采用Scheler公式对2θ为44°和82°两衍射峰对应的晶粒尺寸进行计算,随着镀层中含铁量增加,Ni、Fe0·64Ni0·36和镍纹石相的晶粒尺寸由21 nm细化为11·5nm,铁纹石相的晶粒尺寸由24·5 nm增大到32·8nm.可见电镀Fe--Ni合金可获得纳米级微晶结构,Fe元素细化高含Ni的Fe--Ni合金相的同时也粗化了高含Fe的铁纹石相.衍射峰的变化说明随着镀层中含Fe量的增加,细化的高含Ni的Fe--Ni合金相数量减少,高含Fe的铁纹石相数量增加. 2·3镀液中Fe2+浓度对镀层显微硬度的影响 图4为镀液中Fe2+浓度与镀层的显微硬度的关系曲线.由图可见:单纯的镀镍层的显微硬度仅为274HV[3],随着镀液中Fe2+浓度增大,镀层的显微硬度先增大后减小,当镀液Fe2+浓度为0·01mol·L-1时,显微硬度存在最大值为569HV,当Fe2+浓度为0·03~0·07mol·L-1时出现一个显微硬度平台,约为520HV.
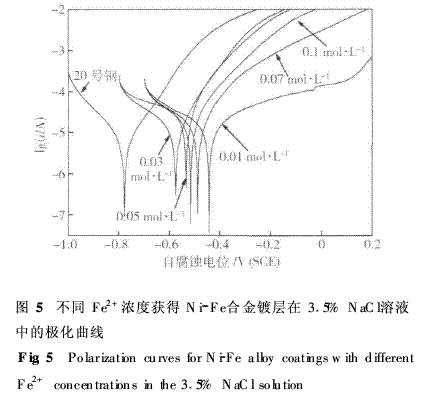
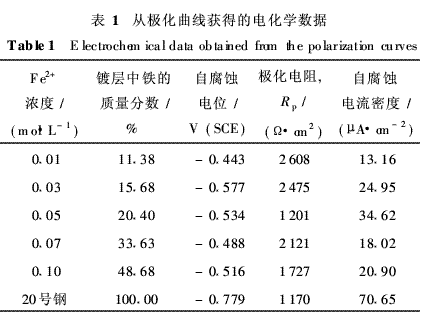
分析认为:镀层显微硬度的变化与Fe原子在Ni晶格中有序固溶程度有关. Fe—Ni键强于Ni—Ni键,纯镍镀层由Ni—Ni键组成,显微硬度较低;当Ni的晶格中固溶少量Fe原子时,可形成强的Fe—Ni键有序固溶,产生较均匀的晶格畸变(见2·2所述),使合金镀层的显微硬度显著提高;当固溶Fe原子量增多时,将形成无序固溶或偏聚固溶,出现Fe—Fe键,产生不均匀的晶格畸变,反而降低晶体间结合强度,造成显微硬度降低. 2·4镀液中Fe2+浓度对镀层耐蚀性的影响 不同Fe2+浓度镀液获得不同含铁量的Fe--Ni合金镀层,不同含铁量镀层和20号钢基体在3·5%NaCl溶液中的极化曲线如图5所示,从极化曲线测得的自腐蚀电位和自腐蚀电流如表1所示.由图5和表1可以看出:不同含铁量镀层的自腐蚀电位均比20号钢基体正很多,当Fe2+浓度为0·01mol·L-1时,曲线上的自腐蚀电位最正,自腐蚀电流密度最低,在阳极段曲线上出现明显的钝化区,该Fe2+浓度镀液获得的镀层在3·5% NaCl溶液中具有较好的耐蚀性,比基体耐蚀性提高5倍多.随着镀液中Fe2+浓度增大,所得试样的极化曲线不再出现钝化区,自腐蚀电位均负移,自腐蚀电流密度增大,但自腐蚀电流密度与镀液中Fe2+浓度间变化规律不明显.
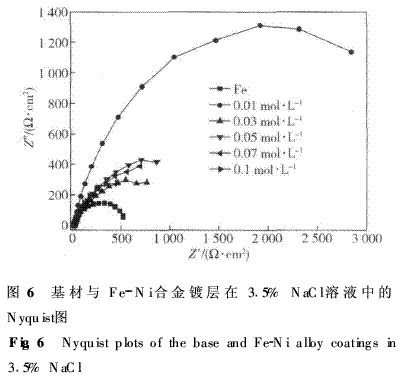
2·5Fe--Ni合金镀层耐蚀机理的研究 采用电化学阻抗谱法对不同Fe2+浓度制备的Fe--Ni合金镀层的耐蚀机理进行了研究.基材与Fe--Ni合金镀层在3·5% NaCl溶液中电化学阻抗谱(EIS)的Nyquist图见图6.
采用ZSimpW in 3·21软件对Nyquist图进行拟合,拟合结果如表2所示.由图6可见:基材阻抗谱接近半圆弧,整个阻抗谱呈单容抗弧,存在一定的弥散效应.对于基材,腐蚀只在基材表面进行,腐蚀行为以均匀腐蚀为主,阻 抗主要来自基材与腐蚀介质界面反应电阻Rt与双电层电容Cdl,由于基材表面粗糙,存在弥散效应,故用Rs(QRt)等效电路进行拟合.拟合后双电层等效元件Q的弥散指数n为0·8,接近于1,代表基材和介质界面处的电容反应较强.此时电极的Faraday过程的速度只受电极电位控制,只有一个时间参数,极化电阻R=R=714Ω·cm2,如表2所示.
图6中Fe--Ni合金镀层整个阻抗谱约1/4圆弧,采用Rs(Qa(Rp(QdRt)))等效电路进行拟合,其中Rs为溶液电阻,Rt为电荷传递电阻,Qd为代表双电层电容的常相位角元件,Qd--YQ为其导纳,Qd--n为双电层电容常相位角元件的弥散指数,Rp为微孔扩散电阻,Qa为代表微孔电容的常相位角元件,Qa--YQ为其导纳,Qa--n为微孔电容常相位角元件的弥散指数.电镀Fe--Ni合金镀层存在一定的孔隙率,电解质溶液通过镀层表面的微孔渗入镀层并达到镀层/基底金属界面,因此与基体相比, Fe--Ni合金镀层的阻抗谱中多了局部存在的微孔扩散电阻和微孔电容,孔隙率越大,镀层的真实表面积越大,形成的电容值越大.Rt值越大,材料发生溶解放电的阻力越大,耐蚀性越好.由表2可见,在普通20号钢基材上电镀Fe--Ni合金镀层后,Rt值不同程度提高,特别是当镀液中Fe2+浓度为0·01mol·L-1时,Rt值最大,约是基材的6倍,其耐蚀性得到显著提高,与极化曲线的实验结果相一致.表2中当Qa--n=1时相当于纯电容C,即镀层中微孔电容.由表2可见随着镀层中含铁量增大,镀层的微孔电容显著增大可见镀层中含铁量增大的同时也增加了镀层中的孔隙率. 由XRD分析可知本研究电镀的Fe--Ni合金具有纳米结构,目前关于纳米结构对耐蚀性的影响还没有定论,有人研究认为材料表面纳米化可提高耐蚀性[13--15];也有人认为纳米化表面增加了晶界的数量,反而降低了材料耐蚀性[16].笔者认为:如果材料本身是易钝化的,可形成致密的钝化膜,则纳米化表面加速钝化膜的生成,有利于耐蚀性能的提高,但如果材料没有钝化特性,则纳米化表面反而会降低耐蚀性.当Fe2+浓度为0·01mol·L-1时,镀层耐蚀性较好,具有明显的钝化特征,这取决于高含Ni的Fe--Ni合金相的钝化特性;随着镀层中含Fe量的增加,可钝化的高含Ni的Fe--Ni合金相的数量减少,高含Fe的铁纹石相数量增加,耐蚀性降低.与此相反,镀层中Fe含量增加的同时大大细化了高含N的Fe--Ni合金相,晶粒尺寸由21 nm细化为11·5nm,而纳米化的高含Ni的Fe--Ni合金相更易于钝化,会提高耐蚀性.正是由于这样一对矛盾,镀层的耐蚀性与镀液中Fe2+浓度间没有明显的变化规律.此外,镀层中含铁量增大的同时也增加了镀层中的孔隙率,这也是镀层耐蚀性下降的主要原因之一. 3·结论 (1)电镀Fe--Ni合金可获得纳米结构,随镀液中Fe2+浓度增大,电镀Fe--Ni合金的镀速降低,镀层中的含铁量增加. (2)镀层显微硬度的变化与Fe原子在Ni晶格中有序固溶程度有关.当Ni的晶格中固溶少量F原子时,可形成Fe--Ni键有序固溶,使镀层显微硬度显著提高;当固溶Fe原子量增多时,形成无序固溶或偏聚固溶,造成显微硬度降低. (3)在普通20号钢基材上电镀Fe--Ni合金镀层后,电荷传递电阻不同程度地提高,镀层的耐蚀性提高;当镀液Fe2+浓度为0·01mol·L-1时,获得的镀层具有较好的耐蚀性,比20号钢基材提高近6倍. (4)随镀层中含铁量增大,可钝化的高含Ni的Fe--Ni合金相的数量减少,耐蚀性降低;而细化了的高含Ni的Fe--Ni合金相耐蚀性提高.这样一对矛盾使镀层的耐蚀性与镀液中Fe2+浓度间没有明显的变化规律.此外,镀层中含铁量增大的同时也增加了镀层中的孔隙率,这也是镀层耐蚀性下降的主要原因之一. 参考文献:略 注:本站部分资料需要安装PDF阅读器才能查看,如果你不能浏览文章全文,请检查你是否已安装PDF阅读器! |